- DPR RI
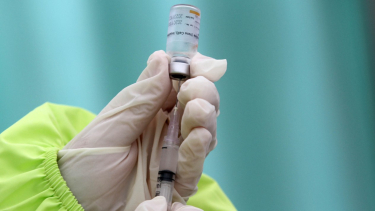
VIVA – Vaksin Nusantara, vaksin COVID-19 dalam negeri yang tengah dikembangkan mantan Menteri Kesehatan Terawan Agus Putranto beserta tim risetnya, belum mendapat Persetujuan Pelaksanaan Uji Klinik (PPUK) untuk fase kedua dari Badan Pengawas Obat dan Makanan (BPOM).
Kepala BPOM Penny K Lukito mengatakan belum keluarnya uji klinis fase kedua lantaran tim peneliti Vaksin Nusantara belum membahasnya lebih lanjut bersama BPOM. Hal itu yang membuat perizinan ditunda hingga pembahasannya jelas dan detail.
"Kenapa sampai dengan saat ini PPUK yang kedua belum karena kita belum selesai dalam membahas bersama dengan tim peneliti dari fase pertama dan itulah yang kami minta dan sudah sangat lama kami minta," kata Penny dalam rapat dengar pendapat dengan Komisi IX DPR, Rabu, 10 Maret 2021.
BPOM juga melihat ada permasalahan dalam uji klinis tahap pertama terkait aspek uji klinik yang baik. Penelitian tersebut dinilai tak sesuai kaidah yang berlaku, karena hal ini berkaitan erat dengan ilmu sains dan kesehatan masyarakat luas.
"Pemenuhan kaidah good clinical practice juga tidak dilaksanakan dalam penelitian ini. Penelitian uji klinik pada manusia harus mengikuti good laboratory practice, good clinical trial practice, dan manufacturing practice," ujarnya.
Selain itu, lanjut Penny, ada ketidaksesuaian protokol dan ketentuan dari Persetujuan Pelaksanaan Uji Klinik (PPUK). Dimana, persetujuan etik dari Vaksin Nusantara diberikan oleh Komite Etik RSPAD Gatot Subroto. Padahal, uji klinik vaksin tersebut dilakukan di RSUP dr Kariadi Semarang.
Menurutnya, sekalipun persetujuan lolos kaji etik bersifat universal atau berlaku di mana saja, namun dalam kaidah klinis pengembangan vaksin setiap tim peneliti harus memiliki komite etik di tempat pelaksanaan penelitian vaksin.
Sebab, komite etik harus bertanggung jawab terutama dalam hal keselamatan subjek penelitian.
Beberapa perbedaan juga terlihat dalam data yang diberikan tim uji klinis Vaksin Nusantara dengan yang dipaparkan dalam rapat kerja dengan DPR, Rabu. "Tapi data tersebut sudah kami review, sudah kami berikan surat dengan tembusan Kementerian Kesehatan untuk mendapatkan respons dari tim peneliti," ungkapnya.
BPOM akan melakukan pertemuan panel hearing dengan tim peneliti Vaksin Nusantara untuk melakukan peninjauan data interim dari fase pertama pengujian vaksin tersebut, yang akan digelar 16 Maret 2021.
Panel tersebut akan menghadirkan tim peneliti Vaksin Nusantara dan para pakar antara lain dari Indonesian Technical Advisory Group on Immunization (ITAGI), Komnas Penilai Obat, serta ahli farmakologi dan ahli biomolekuler.
"Jadi saya minta kita bersabar berikan waktu untuk ada proses dengan tim penelitinya sebagai bagian dari proses kita melakukan review uji klinik fase satu sebelum bisa berlanjut ke fase dua," terang Penny.
- VIVA/M Ali Wafa
Sementara itu, Komisi IX DPR menilai BPOM sengaja tak memberi dukungan atas pengembangan vaksin tersebut. Anggota Komisi IX DPR Saleh Partaonan Daulay mempertanyakan BPOM yang cenderung mempersulit administrasi pengembangan Vaksin Nusantara. Sementara vaksin-vaksin dari luar negeri, cenderung diperlonggar.
Saleh menyoroti BPOM yang menurutnya sangat longgar dalam menerapkan aturan untuk vaksin dari luar negeri. Baik itu Sinovac asal China, maupun vaksin terbaru yang diizinkan masuk lagi yakni AstraZeneca yang berasal dari Inggris.
"Saya mau kasih tahu kadang-kadang Badan POM ini longgar. Tapi yang punya luar negeri. Apa buktinya, AstraZeneca itu Emergency Use Authorization (EUA) tidak ada di Indonesia. Ambilnya katanya emergency use di negara lain. Tapi bisa masuk ke sini," jelas dia.
Sementara Vaksin Nusantara yang diteliti di dalam negeri, oleh anak-anak negeri sendiri, prosesnya harus dihentikan sementara. Ia mempersoalkan masalah ini, jangan sampai ada sesuatu di balik ini.
"Tolong vaksin ini kalau memang ini bisa. Kecuali kalau bapak-bapak, ibu Penny (Kepala BPOM) bisa membuktikan kalau vaksin ini berbahaya, membunuh orang. Saya bersama ibu Penny akan menghajar Vaksin Nusantara," tegas Saleh.
Jangan Sampai Gigit Jari
Saleh berharap agar persoalan vaksin ini juga tidak hanya melihat dari buatan luar negeri. Tetapi apa yang sedang dikembangkan oleh peneliti di dalam negeri dan wajib mendapat perlakuan adil.
Terlebih lagi penelitian Vaksin Nusantara menggunakan sel dendritik. Saleh mendapat informasi, yang menggunakan metode ini baru AS dan kini Indonesia. Sementara China sedang ingin mengembangkan juga.
"Jangan sampai diambil China dulu baru kita beli ke China, dagang lagi ini," katanya.
Hingga akhirnya, Indonesia tidak bisa mengembangkan vaksin sendiri akibat dipersulit. Hanya bisa membeli, padahal anggaran juga tidak sedikit, mencapai puluhan triliun. Jika bisa diproduksi sendiri dengan harga yang kompetitif, menurut Saleh tak ada salahnya mempermudah pengembangan vaksin COVID-19 di Tanah Air.
Kepala BPOM Penny K Lukito menepis anggapan sengaja mempersulit izin Vaksin Nusantara. Penny menegaskan bahwa persetujuan tersebut bukan perkara sepele sehingga harus berbasis keilmuan yang jelas.
"BPOM akan transparan, kami tidak memiliki kepentingan untuk menutupi apapun. Tapi ini merupakan sebuah proses yang berbasis scientific," tegasnya.
- DPR RI
Mantan Menteri Kesehatan Terawan Agus Putranto yang menjadi inisiator penelitian Vaksin Nusantara, menegaskan Vaksin Nusantara memakai sel dendritik sebagai bahan utama dalam melawan virus SARS-CoV-2.
Menurutnya, sel dendritik sebenarnya sudah lama dikembangkan di RSPAD Gatot Subroto sejak tahun 2015, jauh sebelum COVID-19 ada dan menyebar. Pada waktu itu penelitian sel dendritik masih dikhususkan untuk penyakit kanker.
"Ini terus berkembang, sehingga begitu ada ide untuk dendritik vaksin untuk COVID-19, gayung jadi bersambut," tutur Terawan.
Tim peneliti telah mendapat uji coba vaksin dari sel dendritik itu terhadap hewan melalui pihak ketiga di Amerika Serikat. Hal itu yang membuat Terawan makin optimistis melangkah dalam pengembangan vaksin COVID-19.
Vaksin dengan sel dendritik ini, lanjut Terawan, dinilai sangat aman lantaran merupakan autolog yang bersumber dari darah pasien sendiri. Untuk pengembangannya, Terawan melakukan bersama tim peneliti di RSUP dr. Kariadi Semarang bersama Universitas Diponegoro.
"Mudah-mudahan ini bisa terus berlanjut supporting dari Kementerian Kesehatan dan juga Badan POM. Meskipun PPUK belum keluar saya tetap ucapkan terima kasih kepada Badan POM dan Kementerian Kesehatan, semoga ini bisa terus dilanjutkan," imbuhnya.